17/07/2022
Rodziny reagujących krzyżowo alergenów molekularnych – implikacje kliniczne
Profiliny
Profilina identyfikowana jako alergen roślin jednoliściennych i dwuliściennych, jest małym białkiem (12-15 kDa), obecnym we wszystkich komórkach eukariotycznych, stanowiącym element cytoszkieletu i uczestniczącym w transdukcji sygnału. Biochemicznie jest monomerycznym białkiem wiążącym aktynę, istotnym dla mechanizmu ruchu komórek, cytokinezy i sygnalizacji. Uczulenie na profilinę jest przyczyną nawet 60% przypadków alergii na pyłki, przy czym praktycznie zawsze poprzedzone jest uczuleniem na alergeny dla pyłku specyficzne. Objawy kliniczne uczulenia na pyłki są zmienne, ale na ogół występują zawsze. Profilina jest przyczyną 50% alergii na pokarmy pochodzenia roślinnego. Ze względu na wrażliwość profiliny na działanie pepsyny, typowe objawy alergii dotyczą zespołu alergii jamy ustnej, chociaż na terenach o dużej prewalencji uczulenia na pyłki traw, ekspozycja na profilinę w pokarmie może wywołać reakcje ogólnoustrojowe. Profilina jest odpowiedzialna za uczulenie na surowe owoce, takie jak: melon, arbuz, owoce cytrusowe, banan, ananas, kaki, cukinia czy pomidor przy czym alergenność tych źródeł ulega redukcji podczas przetwarzania. W przypadkach niektórych chorych spektrum szkodliwych pokarmów roślinnych jest bardzo duże. Ekstrakt surowego lateksu wykazuje reaktywność z IgE osób uczulonych na pyłek, jednakże eliminacja produktów z naturalnego lateksu redukuje niebezpieczeństwo związane z tego typu reakcją u chorych wymagających interwencji chirurgicznych.
*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
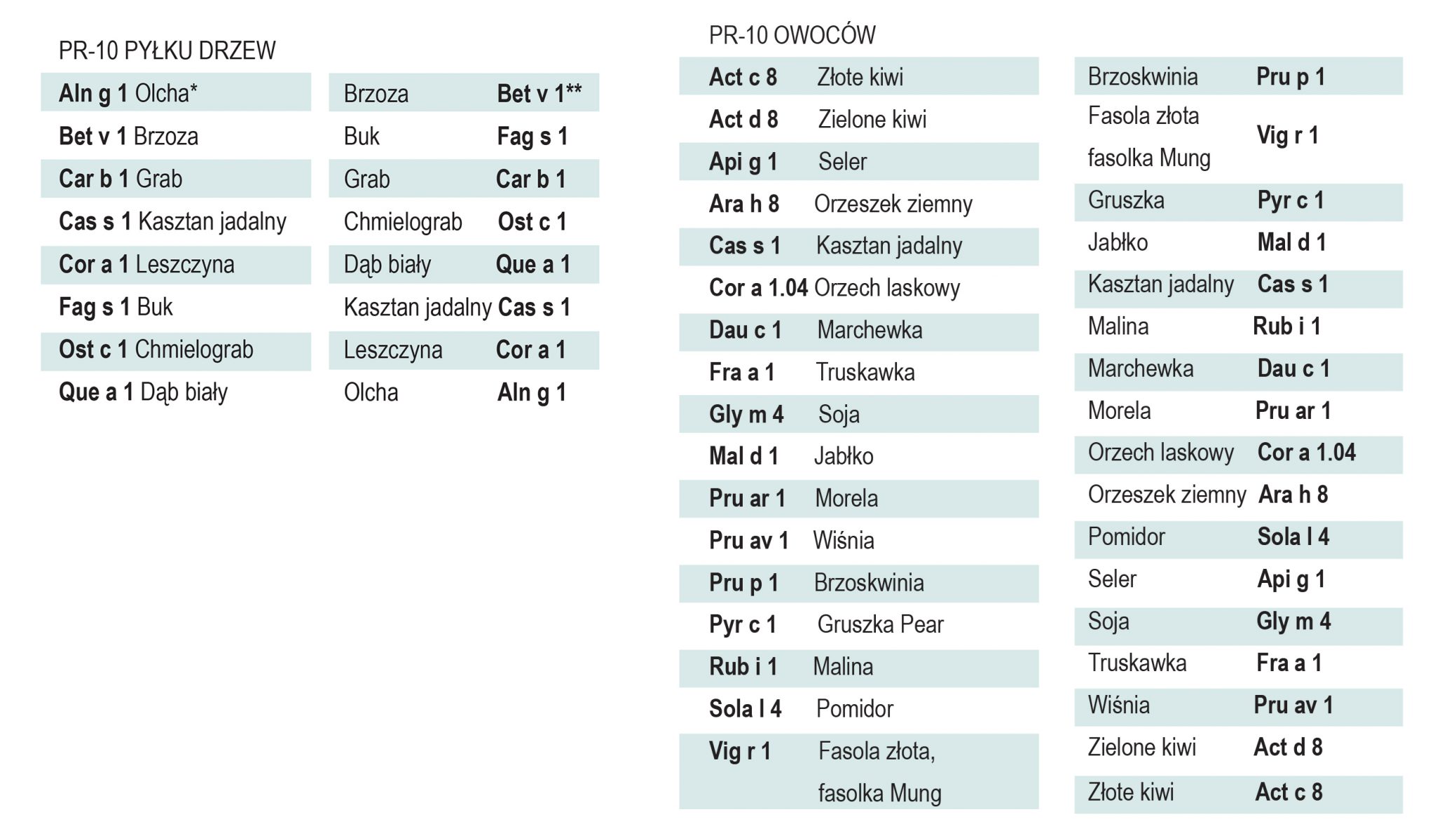
Alergeny podobne do PR-10 (podrodzina rodziny Bet v 1)
Prototypem wszystkich alergenów podobnych do PR-10 (ang. PR-10-like) jest główny alergen pyłku brzozy, Bet v 1, odpowiedzialny za uczulenia w regionach występowania brzozy. Homologi Bet v 1 obecne w pyłku innych Bukowców (Fagales) odpowiadają za reaktywność krzyżową IgE z pyłkami wcześnie kwitnących: leszczyny, olchy, buka, dębu i grabu.
Niewielkie ilości alergenów PR-10 obecnych w surowych owocach, orzechach, warzywach i roślinach strączkowych mogą wywoływać osobniczo zróżnicowane miejscowe objawy w jamie ustnej i gardle, natomiast ciężkie reakcje alergiczne występują jedynie u osób uczulonych uprzednio przez Bet v 1. W diagnostyce takich przypadków wystarczające jest stwierdzenie obecności IgE swoistych dla Bet v 1. Krzyżowe reakcje pyłków lub pokarmów zawierających homologi Bet v 1 mogą być rozpoznawane jedynie na podstawie sezonowości objawów i analizy diety, bez szczegółowych badań w kierunku sIgE. PR-10 posiadają wspólną strukturę o siedmiu antyrównoległych niciach pofałdowania beta, z długą C-końcową helisą alfa i dwoma krótki helisami alfa. W obrębie cząsteczki znajdują się długie fragmenty o dużej swoistości i krótkie sekwencje (17 kDa) reagujące krzyżowo.
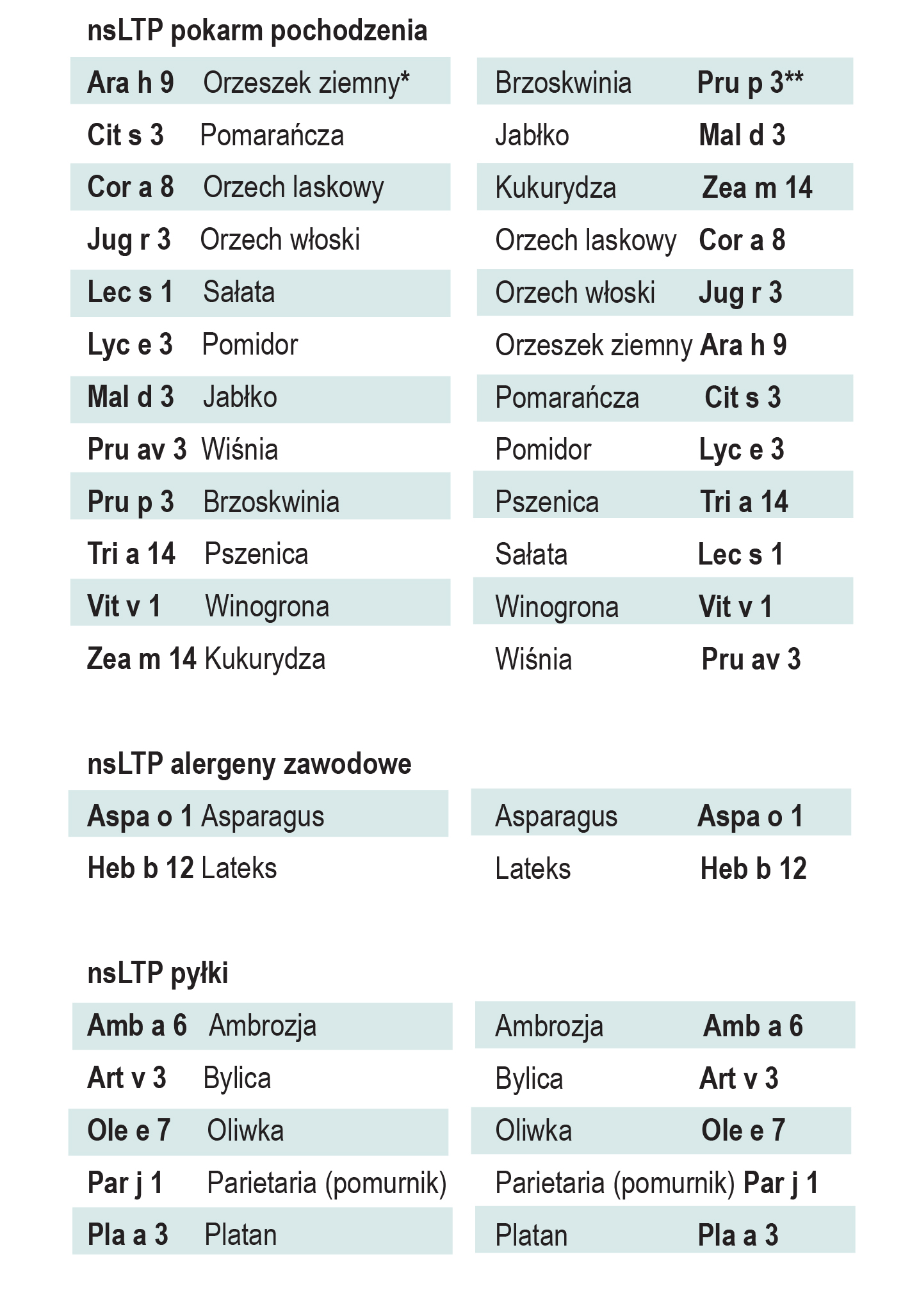
nsLTP
nsLTP (ang. non-specific lipid transfer proteins) są najbardziej rozpowszechnionymi alergenami pokarmowymi roślin w Europie Południowej. Należą do nadrodziny prolamin, obejmującej m.in. rodziny inhibitorów alfa-amylazy i albuminy 2S. W przeciwieństwie do innych członków nadrodziny, nsLTP nie są ograniczone do tkanek nasion, ale są obecne w całej roślinie: owocach, liściach, korzeniach i pyłkach. Stężenie nsLTP jest zmienne i zależy od stopnia dojrzałości, warunków przechowywania i odmiany owocu. Alergeny rodziny nsLTP mogą powodować ciężkie, ogólnoustrojowe reakcje alergiczne, zwłaszcza, jeśli nie są związane z uczuleniem na pyłek brzozy, charakterystycznym dla Europy Północnej. Alergenem pierwotnym w uczuleniu nsLTP jest główny alergen brzoskwini, Pru p 3, posiadający dużą masę (9,178 kDa) i strukturę alfa-helisy. LTP posiadają trzy peptydowe epitopy wiążące IgE, oznaczone jako Pru p 311-20, Pru p 331-40, Pru p 371-80, wspólne dla jabłka, moreli, śliwki, wiśni, pomarańczy, truskawki i winogrona, o identyczności sekwencji 62 to 81%. Obok roślin z rodziny różowatych, źródłem pokarmu pochodzenia roślinnego zawierającego istotne kliniczne alergeny nsLTP są: orzechy oraz zboża: pszenica, kukurydza i ryż.
*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
Albuminy surowicy
Albuminy surowicy są obecne i istotne jako alergeny w osoczu, mięsie i ogólnie wydzielinach (głównie ślinie i mleku) zwierząt. Albuminy surowicy są obecne również w złuszczonych naskórkach i łupieżu zwierząt, przenoszone na sierści jako alergeny oddechowe (wziewne). Jako alergeny małe naskórka/łupieżu odpowiadają za 30% przypadków alergii na sierść zwierząt. Biochemicznie stanowią termolabilne białka o znacznym ciężarze i strukturze alfa-helisy. Posiadają silnie konserwatywne domeny o wysokiej identyczności sekwencji, przekraczającej w niektórych przypadkach 80%. Jako alergen pokarmowy powodują uczulenia na mięso i jaja. Są odpowiedzialne za zespół wieprzowiny-kota i zespół ptasiego jaja. Mogą wywoływać poważne objawy po spożyciu pokarmu niepoddanego obróbce cieplnej (pieczeniu, gotowaniu etc.). Prominentnym przykładem albumin jest Bos d 6, albumina surowicy wołu, BSA (ang. Bovine serum albumin). Alergeny molekularne z tej grupy nie mają zastosowania w swoistej immunoterapii alergii.

*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
Tropomiozyny
Tropomiozyny to termostabilne, silnie alergizujące, reagujące krzyżowo (uważane za panalergeny) alergeny molekularne obecne w różnych źródłach, powodujące zróżnicowane objawy uczulenia, łącznie z anafilaksją. Biochemicznie posiadają strukturę podwójnej alfa-helisy i wykazują wysoką identyczność sekwencji aminokwasów. Są produkowane przez komórki mięśniowe i niemięśniowe. Do uczulenia na tropomiozyny może dojść drogą pokarmową (owoce morza), drogą oddechową (roztocza, karaluchy) lub przez parazytozę (glistnica, anisakioza). Niedoceniony wydaje się efekt kliniczny tropomiozyn niezwiązanych z alergią na żywność. W przypadku alergii na krewetki identyfikacja sIgE dla tropomiozyn in vitro jest bardziej specyficzne i posiada wyższą dodatnią wartością predykcyjną niż identyfikacja sIgE dla pełnego ekstraktu.

*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
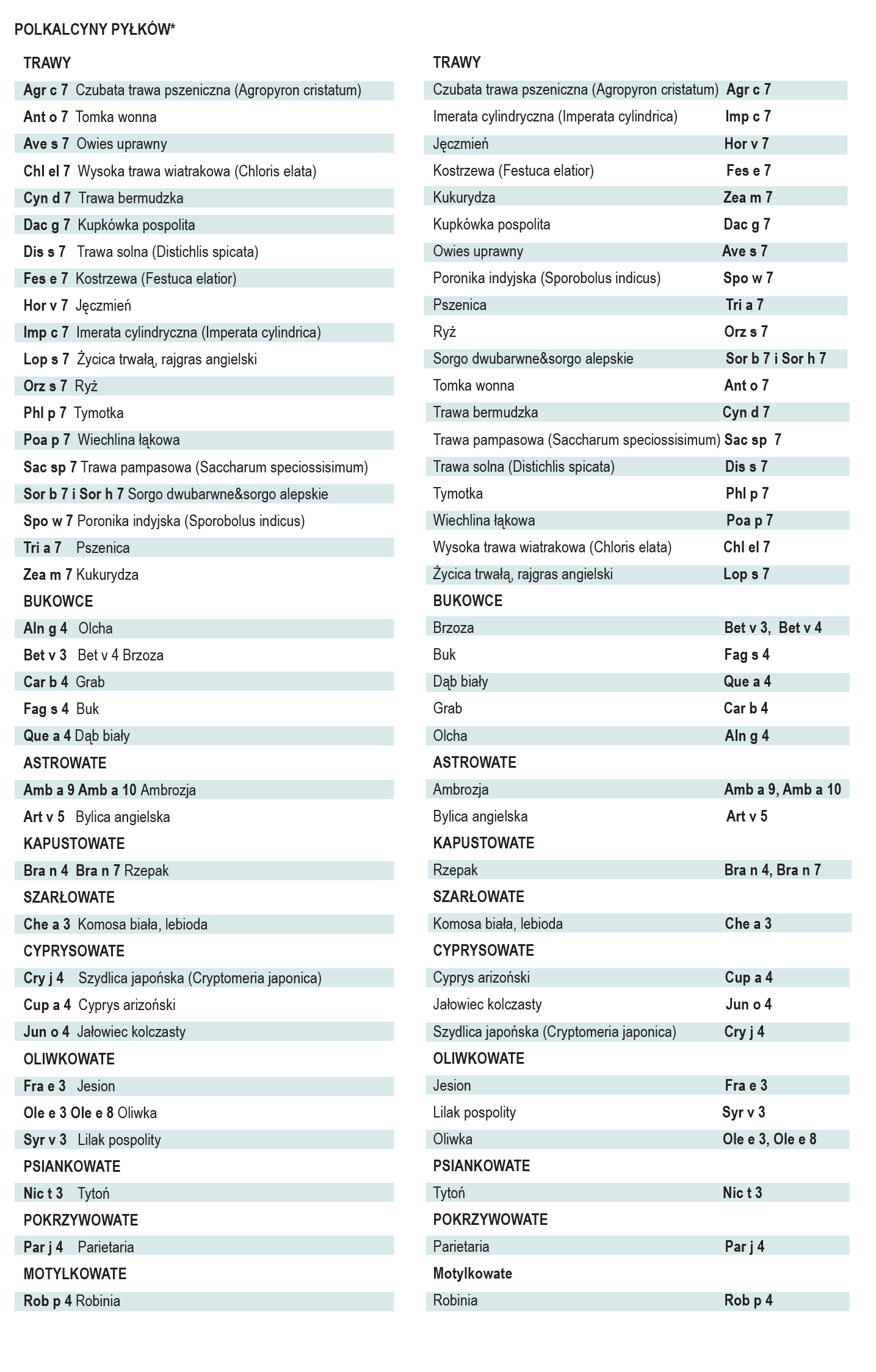
Polkalcyny
Polkalcyny są małymi alergenami w przypadku uczuleń na pyłki traw, drzew lub chwastów oraz markerami ich reaktywności krzyżowej. Nie występują w pokarmach pochodzenia roślinnego. Biochemicznie są małymi białkami o strukturze alfa-helisy, wiążącymi wapń za pomocą strukturalnych motywów dłoni – EF (pętla łącząca helisy E i F), o dużej swoistości sekwencji (77%). Epitopy polkalcyn ulegają pod wypływem jonów wapnia zmianom konformacyjnym. Do ekspresji polkalcyn dochodzi w dojrzałym pyłku i łagiewce pyłkowej. Polkalcyny z różnych źródeł wykazują silną międzygatunkową reaktywność krzyżową. Do identyfikacji in vitro sIgE dla polkalcyn można posłużyć cię dowolnym przedstawicielem rodziny. Wykazanie uczulenia na polkalcyny może być traktowane jako marker poliuczulenia o nieokreślonym klinicznie związku z objawami ze strony układu oddechowego.
Lipokaliny
Do rodzin lipokalin należą małe białka (16-25 kDa) posiadające wspólną strukturę trzeciorzędową ze środkową beta baryłką, wydzielane do przestrzeni okołokomórkowej, z fragmentami o wysokiej i niskiej identyczności sekwencji łańcuchów białkowych w obrębie rodziny, z których te pierwsze odpowiadają ze reaktywność krzyżową w obrębie rodziny. Wydzielane przez gruczoły podjęzykowe i w małych ilościach przez gruczoły podżuchwowe oraz przez wątrobę. Jako alergeny są przenoszone przez futro i bezpośrednio przez ślinę i mocz. Przenoszone drogą powietrzną łatwo penetrują do pomieszczeń zamkniętych. Uczulenie na lipokaliny stanowi czynnik ryzyka astmy i objawów ze strony układu oddechowego. Nie został jednak poznany wpływ poszczególnych cząsteczek na nasilenie objawów. Cząsteczki lipokalin nie są wykorzystywane do swoistej immunoterapii.

*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
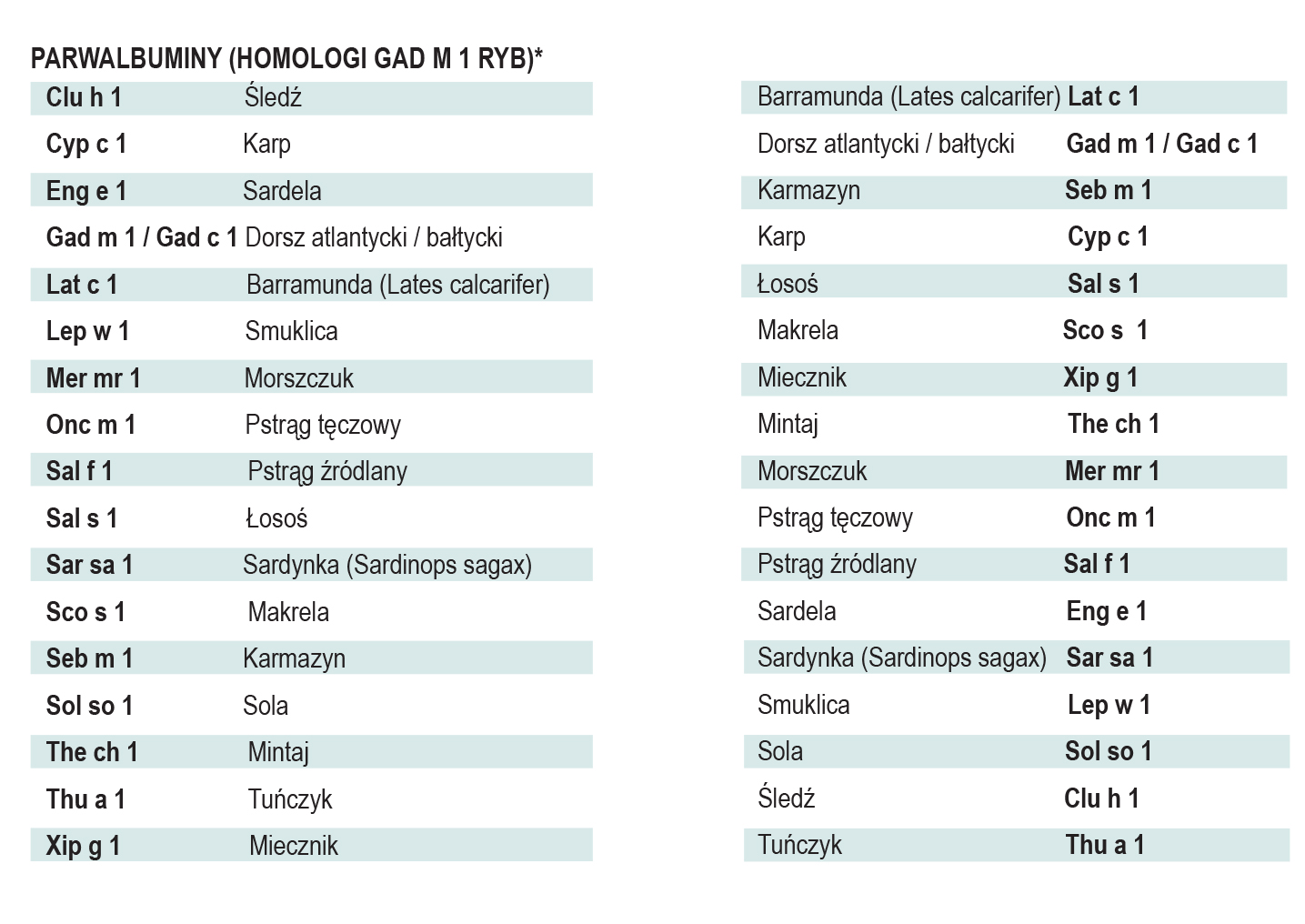
Parwalbuminy
Parwalbuminy są panalergenami ryb, uczulającymi drogą pokarmową (alergeny pokarmowe) i oddechową (alergeny wziewne), wykazującymi odporność chemiczną i fizyczną na proces przetwarzania. Biochemiczne są małymi, nieglikozylowanymi białkami cytozolowymi mięśni ryb (i pęcherza pławnego) należącymi do rodziny białek wiążących Ca2 + (wiążą Ca+ i Mg+); o ciężarze 11,55 kDa, długości 107-110 aminokwasów i strukturze alfa helisy. Posiadają kilka izoform wstępujących w mięśniach równocześnie, z których najważniejsze są izoformy β1- i β2. W przypadku monouczulenia identyfikuje się sIgE specyficzną dla epiotpu gatunkowo-specyficznego, jednakże parwaluminy wykazują dużą reaktywność krzyżową w obrębie rodziny, wynikającą z konserwatyzmu epitopów.
*-alfabetycznie wg nazw alergenów
**-alfabetycznie wg gatunków
dr Tomasz Ochałek
Laboratoria Medyczne DIAGNOSTYKA
Wybrana pozycja piśmiennictwa
Wg. MOLECULAR ALLERGOLOGY, USER’S GUIDE, eds. P. M. Matricardi, J. Kleine-Tebbe, H. Jürgen Hoffmann, R. Valenta, M Ollert, European Academy of Allergy and Clinical Immunology, 2016.
Zachęcamy do przeczytania pozostałych artykułów o Alergiach, przygotowanych przez naszych specjalistów:
ALERGIA I – Od ekstraktów do alergenów molekularnych
ALERGIA II – Strategie diagnostyczne chorób alergicznych
ALERGIA III -Diagnostyka molekularna alergii
ALERGIA IV – Implikacje kliniczne i diagnostyczne pomiarów sIgE
