19/07/2022
Diagnostyka molekularna alergii
Skokowa zmiana w pozycjonowaniu pomiarów sIgE w diagnostyce chorób alergicznych nastąpiła w momencie narodzin diagnostyki molekularnej alergii (ang. molecular allergology), operującej pojęciem alergenu określanego jako cząsteczka białka o określonej strukturze fizycznej (kłębek statystyczny, dimer, globulina etc.), zdefiniowanej funkcji biochemicznej (np. określony enzym) i roli fizjologicznej (np. białko spichrzowe czy obronne roślin). Alergeny molekularne izolowane są metodami biochemicznymi z ekstraktu tzw. źródła alergenu, stanowiącego alergen w klasycznym ujęciu (alergeny wysokooczyszczone oznaczone literą n przed nazwą cząsteczki) lub uzyskiwane za metody inżynierii genetycznej białek z wykorzystaniem układów bakterii lub drożdży (alergeny rekombinantowe, oznaczone literą r przed nazwą cząsteczki). Alergeny molekularne wytwarzane metodami inżynierii białek mogą być modyfikowane dla poprawy swoistości diagnostycznej bez utraty czułości). Inaczej mówiąc, w diagnostyce molekularnej, określanej również jako diagnostyka oparta na komponentach, CRD (ang. component-resolved diagnostics), pełne ekstrakty źródeł alergenu zostały zastąpione przez wyselekcjonowane, cząsteczkowe komponenty o udowodnionej zdolności do indukcji uczulenia przez stymulację specyficznej sIgE, a w przypadku przekroczenia pewnego granicznego stężenia sIgE, również do indukcji reakcji alergicznej. Należy dodać, że ekstrakty alergenowe wykorzystywane są nadal w tradycyjnej diagnostyce alergii in vitro samodzielnie lub w połączeniu z alergenami molekularnymi (co dostarcza dodatkowych możliwości interpretacyjnych) oraz jako jedyne przydatne w testach skórnych in vivo.
Sprowadzenie diagnostyki do poziomu molekularnego wiązało się z funkcjonalną redefinicją alergenu, określanego teraz jako zbiór ściśle zdefiniowanych biochemicznie i strukturalnie, immunogennych składników cząsteczkowych – alergenów molekularnych (komponentów molekularnych), obecnych w określonych proporcjach w pełnym ekstrakcie źródła alergenu (np. pyłku roślin, mleka, itd.). Niekiedy, zwłaszcza w piśmiennictwie anglojęzycznym, termin alergen zawężany jest wyłącznie do zdefiniowanej cząsteczki indukującej swoiste przeciwciała, co prowadzi do rozróżnienia pomiędzy alergenami (bez przymiotnika molekularny) i źródłami alergenów (allergen sources). Epitopem alergenu molekularnego, czyli fragmentem wchodzącym w bezpośrednią interakcję z miejscem wiążącym IgE, zwanym paratopem, może być: sekwencja aminokwasów łańcucha peptydowego (epitop liniowy) lub aminokwasy z sąsiednich łańcuchów trójwymiarowej struktury przestrzennej (epitop przestrzenny). Epitop alergenu decydujący o immunogenności nazywany jest determinantą immunodominującą. Znajomość właściwości fizycznych i chemicznych alergenów molekularnych i ich epitopów ma istotne znaczenie diagnostyczne i prognostyczne. Na ogół, epitopy liniowe są termostabilne i odporne na enzymy proteolityczne, podczas gdy epitopy przestrzenne są termolabilne i wrażliwe na enzymy trawienne. W przypadku epitopów przestrzennych, pod wpływem denaturacji cieplnej lub proteolizy mogą tworzyć się nowe epitopy – neodeterminanty, rozpoznawane przez jedynie dla nich swoiste, nowopowstające sIgE.
Diagnostyka in vitro, oparta na identyfikacji uczulających alergenów molekularnych jako składowych alergenów tradycyjnie pojmowanych, zmieniła algorytmy diagnostyczne alergii i wpłynęła na profilaktykę oraz leczenie, choć wykorzystuje zasadę identyczną do zasady testów opartych na ekstraktach alergenowych: identyfikacje we krwi swoistych dla alergenu przeciwciał IgE.
Testy molekularne pozwalają na identyfikację określonego biochemicznie, molekularnego składnika źródła alergenu odpowiedzialnego za uczulenie na źródło jako całość (tzw. źródło alergenu) przez określenie stężenia sIgE „wyłapywanej” przez tenże składnik z próbki badanej surowicy. Odpowiednio dobrany molekularny alergen diagnostyczny – krytyczny element układu testowego, związany jest na ogół z fazą stałą zestawu, w zależności od rozwiązania, będącą powierzchnią płytki, bibułą z odpowiedniego tworzywa sztucznego lub mikro czy nanokulkami (ang. beads). Przekroczenie ustalonego stężenia wychwyconej przez alergen sIgE, wskazuje na ten alergen jako na przyczynę uczulenia, z prawdopodobieństwem proporcjonalnym do stężenia związanej sIgE.
Wzrost znaczenia diagnostyki molekularnej, rozwijanej od przełomu stuleci, nabrał tempa dzięki możliwości uzyskiwania składników molekularnych metodami inżynierii białek w różnego rodzaju systemach ekspresyjnych (np. drożdżach). Rekombinantowe cząsteczki alergenów pozbawione są reszt węglowodanowych lub posiadają reszty cukrowe zmodyfikowane przez odpowiednie zaprogramowanie systemów ekspresyjnych. Modyfikacje mają na celu poprawę swoistości metody bez uszczerbku dla czułości. Ta strategia pozwala na całkowitą eliminację interferencji ze strony nieswoistych reszt węglowodanowych alergenów glikoproteinowych określanych jako CCD (ang. cross-reactive carbohydrate determinants). Obecne w alergenach z różnych źródeł, identyczne, nie immunogenne per se, CCD, zawyżają wyniki pomiarów sIgE in vitro wykonywanych przy użyciu klasycznych, diagnostycznych ekstraktów alergenowych oraz nie modyfikowanych cząsteczek alergenów molekularnych.
Atutem molekularnej diagnostyki alergologicznej jest:
- Różnicowanie monouczulenia, wpółuczulenia i multiuczulenia;
- Różnicowanie uczulenia pierwotnego i objawów reaktywności krzyżowej sIgE z alergenami homologicznymi dla alergenu pierwotnie uczulającego;
- Weryfikacja/prognozowanie fenotypu alergii definiowanego dla określonych komponentów molekularnych, w tym: czasu reakcji po ekspozycji na alergen, objawów i charakteru reakcji (miejscowy/uogólniony), nasilenia reakcji;
- Ocena ryzyka reakcji niebezpiecznych;
- Możliwość prognozowania powikłań i ewolucji choroby (marsz alergologiczny);
- Określanie wzrostu tolerancji na źródło alergenu z wiekiem przez monitorowanie spadku sIgE dla określonych alergenów molekularnych (np. Bos d 4, 5, 8 w przypadku alergii na mleko krowie);
- Ograniczenie ilości testów prowokacyjnych przez identyfikację sIgE dla głównych alergenów molekularnych o seroprewalencji zbliżonej do 100%;
- Prawidłowa kwalifikacja pacjentów do specyficznej immunoterapii alergii (SIT);
- Standaryzacja molekularnych alergenów diagnostycznych o określonych właściwościach biochemicznych, fizycznych i fizjologicznych;
- Poprawa parametrów diagnostycznych: dodatniej (PPV) i ujemnej (NPV) wartości predykcyjnej w porównaniu do diagnostyki opartej na ekstraktach alergenowych;
- Poprawa swoistości bez utraty czułości przez eliminację CCD z molekularnych alergenów diagnostycznych wytwarzanych w odpowiednio zaprogramowanych systemach ekspresyjnych – alergeny rekombinantowe (r) pozbawione CCD;
- Eliminacja wyników fałszywie ujemnych (poprawa czułości) obserwowanych w testach stosujących ekstrakty alergenowe zubożone o niestabilne chemicznie i fizycznie składniki gubione w trakcie ekstrakcji źródła alergenu (niedoreprezentacja antygenu).
Szczegółowa wiedza o właściwościach biochemicznych/fizycznych i immunogenności alergenów molekularnych oraz ich wpływie na fenotyp alergii doprowadziła do sugestii zmiany paradygmatu diagnostyki alergii. Dotychczasowy algorytm diagnostyczny: Top-down (z góry na dół), ukierunkowujący dobór pojedynczych alergenów do testów diagnostycznych (in vivo i in vitro) w oparciu o wywiad kliniczny, został zastąpiony przez algorytm Bottom-up (z dołu do góry), zgodnie z którym historia choroby analizowana jest w oparciu o identyfikację i wynik pomiaru stężenia in vitro sIgE dla spektrum alergenów molekularnych o potwierdzonym i przewidywalnym potencjale uczulającym i fenotypie alergii (Rysunek poniżej).
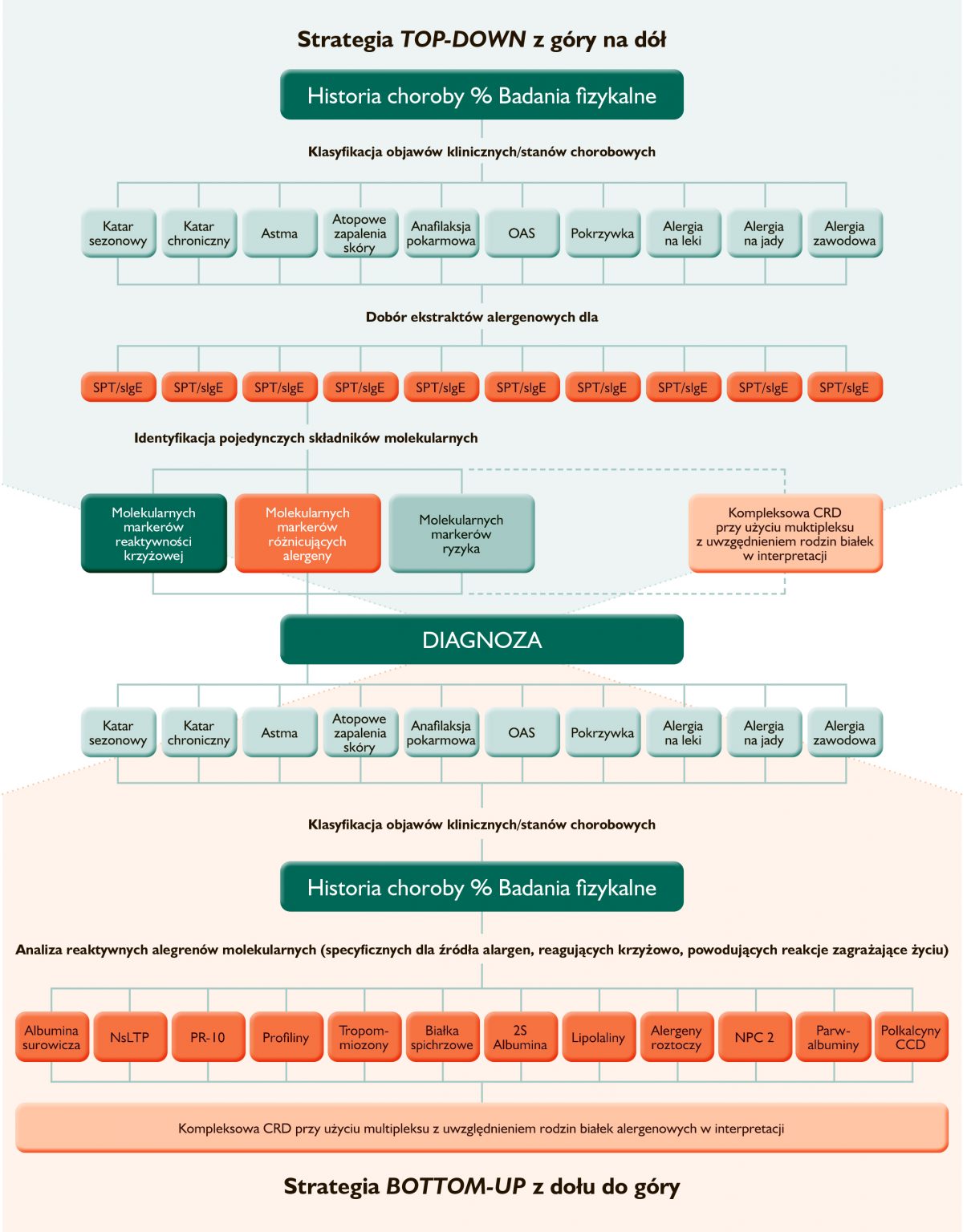
Zestawienie algorytmów diagnostyki alergologicznej: klasycznego – Top down i nowego Bottom up wykorzystującego możliwości stworzone przez molekularne testy multiplexowe. Wg. Molecular allergology, User’s guide, 2016, zmienione.
W algorytmie Bottom-up pierwszym zaleceniem lekarza podejrzewającego alergię jest określenie możliwie jak najszerszego profilu sIgE i ex post ukierunkowywanie wywiadu dla doprecyzowania dalszego toku postępowania. Uzyskany profil uczulenia poddawany jest analizie na podstawie badania przedmiotowego i podmiotowego, dzięki czemu niektóre warianty uczulenia mogą zostać przypisane do objawów klinicznych i zyskać status alergii podejrzewanej. Niekiedy cykl diagnostyczny Bottom-up wieńczony jest, jak w podejściu klasycznym, wykonaniem weryfikującego badania ekspozycyjnego na podejrzewany alergen, jednakże wiedza o potencjale uczulającym poszczególnych alergenów molekularnych, fenotypie klinicznym indukowanej przez nie alergii i określonych homologiach w obrębie rodziny, do której alergen należy, powodują, że konieczność wykonania prowokacji staje się zbędna.
Dla porównania należy przypomnieć, że zgodnie z dotychczasową, wieloletnią, strategią diagnostyczną Top-down zalecaną m.in. przez Instytut Norm Klinicznych i Laboratoryjnych, CLSI, ang. Clinical and Laboratory Standard Institute i zgodną z rekomendacjami polskimi, pełny diagnostyczny algorytm chorób alergicznych zależnych od IgE obejmuje: badanie fizykalne, komplementarne testy diagnostyczne identyfikujące alergenowo-swoistą IgE: in vivo (SPT) i in vitro (pomiar stężenia sIgE), testy funkcjonalne in vitro (np. test aktywacji bazofilów, BAT, ang. basophil activation test) i rozstrzygające testy ekspozycyjne (prowokacje). W wywiadzie, uważanym za punkt wyjścia procedury diagnostycznej: „Clinical history drives the diagnosis” (Wywiad warunkuje diagnozę), typowane są alergeny uczulające, a trafność wyboru potwierdzana jest przez identyfikację specyficznych dla nich IgE. Algorytm Top down mimo doświadczenia lekarza, obdarzony jest sporą przypadkowością i sprowadza się ostatecznie do metody prób i błędów, co znacznie wydłuża proces diagnozy i opóźnia wdrożenie właściwego leczenia i stosownej profilaktyki.
Bez względu na przyjęty algorytm diagnostyczny, identyfikacja IgE wykonywana jest na dwóch drogach: in vitro, przez pomiar stężenia sIgE we krwi oraz in vivo jako testy skórne. Teoretycznie obie metody traktowane są, jak już wspomniano, komplementarnie. W praktyce jednak, mimo szeregu wad (uciążliwość dla pacjenta, brak standaryzacji, wyniki fałszywie dodatnie), większą popularnością wśród lekarzy cieszą się testy in vivo. Być może dlatego, iż wykonywane są w gabinecie lub ambulatoryjnie w pobliżu gabinetu lekarza. Istotne wydaje się również przekonanie, że tkankowa, miejscowa, reakcja skórna na alergen diagnostyczny ze względu na złożony mechanizm i zależność od różnorodnych czynników (reaktywności receptorowej IgE, nasilenia degranulacji mastocytów, aktywności uwalnianych mediatorów: histaminy, leukotrienów i prostaglandyn) jest lepszym wskaźnikiem narządowej reakcji alergicznej niż stężenie sIgE w krążeniu. Tymczasem, dodatnie wyniki SPT bazujących wyłącznie na ekstraktach alergenów diagnostycznych, informują jedynie o obecności IgE reaktywnych dla któregoś ze składników diagnostycznego ekstraktu źródła alergenu, nie wskazując na ten składnik i nie przesądzając, czy jest gatunkowo swoisty czy ma charakter panalergenu. Implikacje kliniczne wiążące się dodatnim wynikiem testu SPT, jak ryzyko alergii i nasilenie objawów, mogą być wyjaśnione wyłącznie po określeniu swoistości przeciwciał sIgE w testach in vitro na poziomie diagnostyki molekularnej. Omawianie kazusów diagnostycznych obejmujących wyniki SPT w połączniu z wynikami pomiarów sIgE in vitro przy użyciu ekstraktów i alergenów molekularnych jest obecnie stałym punktem programu warsztatów alergologicznych w kraju u za granicą.
Unikalne możliwości diagnostyki molekularnej dopuszczają postępowanie diagnostyczne oparte wyłącznie na badaniach in vitro, co jest szczególnie istotne dla lekarzy innych niż alergologia specjalności, pozbawionych zaplecza ambulatoryjnego, a stających przed koniecznością różnicowania alergicznej etiologii objawów swoich pacjentów dla wdrożenia leczenia lub przed ewentualnym skierowaniem ich do specjalisty alergologa.
Dr Tomasz Ochałek,
Laboratoria Medyczne DIAGNOSTYKA
Wybrana pozycja piśmiennictwa
- MOLECULAR ALLERGOLOGY, USER’S GUIDE, eds. P. M. Matricardi, J. Kleine-Tebbe, H. Jürgen Hoffmann, R. Valenta, M Ollert, European Academy of Allergy and Clinical Immunology, 2016.
Zachęcamy do przeczytania pozostałych artykułów o Alergiach, przygotowanych przez naszych specjalistów:
ALERGIA I – Od ekstraktów do alergenów molekularnych
ALERGIA II – Strategie diagnostyczne chorób alergicznych
ALERGIA IV – Implikacje kliniczne i diagnostyczne pomiarów sIgE
